癌と長寿をテーマに連載を続けていますが、難敵の癌を征服することは
糖尿病、過剰免疫疾患を含めた様々な難病をも征服し、多くの人が願う健康長寿を
達成することに繋がります。メカニズムが共通だからです。
癌細胞の代謝による大量の活性酸素発生と好気的解糖(aerobic glycolysis)によって
生じるグルコース(ブドウ糖)は、癌細胞の栄養素として癌細胞を増殖させていきます。
このメカニズム追求が細胞内インスリンシグナル(この場合はグルコース代謝経路での情報伝達)の
下流(伝達段階の先)で制御される遺伝子転写因子といえるタンパク質(FoxO1)の発見につながり、
癌の転移、拡散、成長などの研究発展に繋がりましたが、糖尿病のメカニズム探究にも
大きく貢献しています。
1. なぜ線虫(Caenorhabditis elegans)の研究が必要か?
寿命を縮めるテロメア短縮酵素を阻害する酵素のテロメラーゼを
活性化させるサーチュイン関連物質の研究が長寿や癌の
予防に最も重要ということに異論はほとんどなくなりました。
しかしながら、サーチュインや類似物質の作動、活性化、消滅などの機序が
全て解明されているわけではなく、まだまだ研究途上です。
以前にも話題にしましたが長寿のメカニズムと癌治療の成果を確認するには
50年から100年後でも十分でないといわれますから、予想、予見しかありません。
限られた選択肢の中で、遺伝子の働きが類似する短命の線虫(Caenorhabditis elegans)を
使用して実験することは現実的な選択でしょう。
筆者は同じ重量当たりの比較は計算していませんが、1㎏当たり6,000億個とも1兆個とも
言われるヒト細胞の構成と約1,000個の細胞の線虫(Caenorhabditis elegans)。
線虫の体長は1mm前後。
平均寿命が2週間程度と短い上に、遺伝学解析が容易であることから
老化研究によく用いられてきました。
2. 線虫による実験の場でテロメア短縮を30%以上抑えることに成功
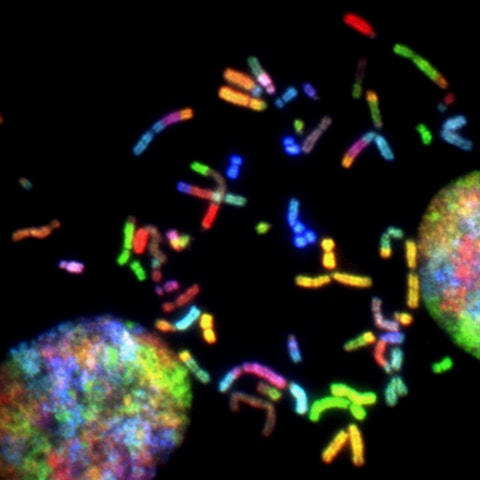
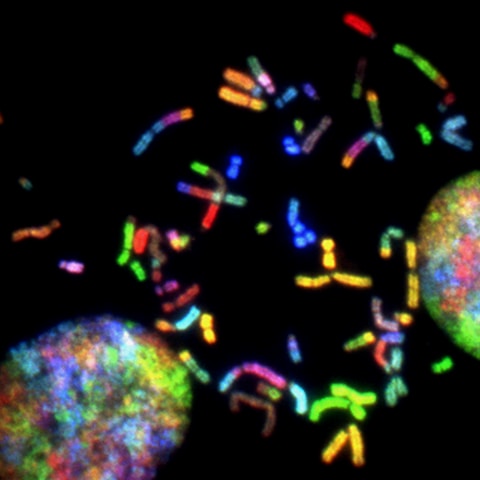
細胞の寿命を決定するのは、染色体に繋がる紐状のテロメア(telomere)だと
考えられています。
細胞分裂毎にテロメアは短くなり、テロメアが無くなると細胞の寿命が尽きます。
通常、50-60回の細胞分裂で寿命が尽きますが、テロメアを短縮させる
老化酵素の働きを抑えることで、寿命を延ばすことが出来ます。
この悪玉(?)老化酵素を制御する酵素はテロメラーゼ(Telomerase)と呼ばれますが、
テロメラーゼを活性化する物質の*サーチュイン(sirtuins)を見出したのは
ガレンテ博士、シンクレアー博士やバイオモル社のホーウィッツ博士など
ハーバード大学、MIT大学の研究者ら。
1999年ごろより、線虫による実験の場でテロメア短縮を30%以上抑えることに
成功しています。
*サーチュイン(sirtuins):silent mating type information regulation 2
線虫(C.elegans)の進化過程でシグナル経路が生命維持の重要経路であることが
実験により確認されましたから、長寿のメカニズム解明に線虫が
華々しく登場したわけです。
現在では染色体端末テロメアを短縮する酵素を阻害するテロメラーゼ酵素の活性化に
(7種類発見されているサーチュインの内)Sir2が重要な関連を持つことが判ってきています。
3. ブーム再来を迎えているテロメア研究
ところが長寿達成が現実的となったとのセンセーショナルなプレゼンテーションが災いしたのか、
「線虫と人とは異なるのでヒトへの効能は信じられない、実験手法にも疑義がある」などの
誹謗が増え、その後は線虫による老化メカニズム研究が低迷。
どちらかといえば予防医学に貢献する基礎研究は人気がありません。
近年の癌(がん)や長寿の研究は、研究者の経済的リターンがより大きい、
遺伝子工学などに基づいた創薬や治療法が主役となっていました。
ところが近年になり先端的なモノクローナル抗体など遺伝子関連治療の
高額医療費が問題となり、各国の医療、保健財政の破たんまで話題がエスカレート。
「富裕層ターゲットの新抗がん剤開発に疑義:
立ち上がったIT産業のビリオネア」
予防医学の必要性が見直されるようになり、
最近ではテロメア周辺の酵素反応の仕組みを明らかにする、癌と長寿の基礎研究が、
各地で進行しています。
第二次テロメア研究ブームの到来といえるでしょう。
4. カリフォルニア大学(UCSF)は長寿と癌の先端的研究所
UCSFはテロメア研究のブラックバーン博士やランゲ博士が所属する大学で、
山中伸弥博士もここの研究所でIPSを発見し、現在でも研究を続けています。
長寿の酵素テロメラーゼはノーベル賞をテロメア研究で受賞した女性科学者の
エリザベス・ブラックバーン博士により発見されました。
ブラックバーン博士はカリフォルニア大学サンフランシスコ校(UCSF)でテロメア研究を
続けていますが近いうちの引退を表明した博士の後継者は同じUCSFで学んだ
女性科学者のランゲ博士。
現在ではロックフェラー大学(NY)でテロメア研究を続けています。
異色の科学者といわれるランゲ博士は創薬志向の研究者達とは異なったスタンスをとり、
食生活の改善が癌予防と長寿への近道であることを分子細胞レベルで
立証することを志しています。
「なぜ精子のテロメアは長く、癌のそれは短い.
現代テロメラーゼ研究の立役者はランゲ博士」

5. 老化研究の主役はケニヨン博士と線虫(C.elegans)
時流に流されずに永年にわたり老化研究の実験動物モデルとして線虫を
研究し続けているのは、同じくカリフォルニア大学サンフランシスコ校UCSFの
シンシア・ケニヨン博士(Cynthia Kenyon)。
世界的な線虫研究の第一人者です。
ケニヨン博士はサーチュイン研究の第一人者MIT教授の
ガランテ博士(Leonard Pershing Guarente)とともにテロメアの研究を続けています。
一時期は二人がサーチュインに関する創薬会社(Elixir Pharmaceuticals)を
立ち上げたこともありました。
ケニヨン博士は米国人。ジョージア大学を卒業後MITで博士号を取得。
ケニヨン博士らによる線虫の長寿形質突然変異体の解析によって
老化にinsulin/IGF-1 シグナル伝達など、いくつものシグナル伝達経路が
関わっていることが明らかになっています。
*インスリンは細胞膜上のインスリン受容体と結合し、いくつかの酵素により
シグナル伝達をします。
すでにケニヨン博士らは線虫突然変異体の解析で、daf-2*とよばれる遺伝子の
機能が低下した変異体は、原型(野生型)に比べて寿命が2-3倍近く延長することを
1993年に明らかにしています。
現在はグーグル・オーナーが設立した「永遠の生命」を目的とした長寿研究所の
カリコ(Calico)にも参加しています。
*daf-2:Dauer formation 2(長寿命線虫変異体:diamino fluorescein-2 diacetate)
ケニヨン博士はdaf-2を「the grim reaper gene」と呼んでいるそうです。
「死を招く遺伝子」と表現したいのでしょう。
「the grim reaper」とは14世紀にヨーロッパで話題となった擬人化された
死の象徴イラスト。
大流行した感染症(ペスト?)の悪魔を表しているのではといわれます。
6. 線虫の突然変異体daf-2と突然変異体daf-16
daf-2(diamino fluorescein-2 diacetate)は
線虫の変異遺伝子で老化速度・寿命の主要調節因子の一つ。
線虫のdaf-2は哺乳動物のインスリン/IGF-1ファミリー受容体
(Insulin like Growth Factor 1 Receptor)と配列が類似しており、
同じ遺伝子ファミリーに属するとみなされています。
内外の研究者らによって、ショウジョウバエやマウスなどでも
インスリン/IGF-1受容体が老化速度・寿命を制御することが明らかにされており、
老化制御の基本的な機構に関わる遺伝子と考えられているとのこと。
さらに近年、食餌制限や生殖細胞系列の欠損などのdaf-2変異体とは独立した
寿命延長経路においても、その長寿命にdaf-16遺伝子が必須であることが
報告されて、ケニヨン博士らは下記の結論を得ています。
・インスリン/IGF-1受容体が老化速度・寿命を制御する
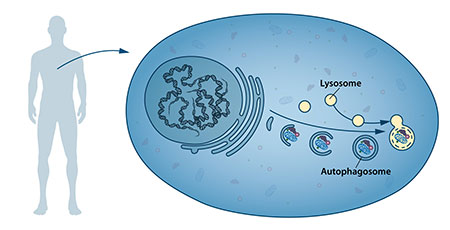
・daf-2 *RNAiによって*オートファジーは活性化される
・Forkhead box(FOX)は転写活性を持つことが明らか。
*RNAi:RNA interference:RNA干渉:ノーベル生理学・医学賞受賞者の Andrew Z. Fire と
Craig C. Melloによって線虫の実験で発見され、 2001年には Elbashirらにより哺乳類での
siRNAによる RNAi 誘導が明らかとなりました(コスモ・バイオ)
*「パンのイーストを使い細胞のオートファジーを解明
老化と生活習慣病は細胞内異変の自動修復作用不全
7. 転写因子Forkhead box(FOX)の転写活性を制御する線虫のdaf-16
フォークヘッド・ボックス(Forkhead box:Fox)は
細胞内インスリンシグナル(情報伝達経路)の下流で制御される転写因子といえるタンパク質の総称。
癌の転移、拡散、成長などに関与する重要物質とみなされ、がん研究の重要な
ターゲットとなっています。
哺乳類のインスリン受容体は線虫のdaf-2ですが、哺乳類のFoxO1は
線虫ではdaf-16です。
DAF-16はFoxOサブファミリーに属する線虫の転写因子(細胞分裂時の遺伝子複製)であり、
血糖値維持にも重要な役割を果たしており、飢餓に応答するFOXO1を介した
糖新生の制御が糖尿病発症メカニズムの研究ターゲットともなっています。