万能細胞(幹細胞)と呼ばれるES細胞は卵子から作りますが、
ノーベル賞を受賞した山中博士のiPS細胞は人の皮膚から摂取した
線維芽細胞(Human Dermal Fibroblasts:ヒト皮膚線維芽細胞)を
使用した万能細胞。
この研究に励まされ(?)京都大学農学部では線維芽細胞による
コラーゲンの体内合成の作用機序研究を進めており、
経口摂取したコラーゲン・ペプチドがアミノ酸に分解されて消滅という
説を覆し、骨、皮膚、筋肉、神経細胞などの体組織を形成する(だろう)
ヒト実験に成功しています。
話題の皮膚、関節など結合組織の再生医療最前線!!コラーゲンを知ることで
理解が深まります。

1. 再生医療最前線:京都大学農学部のコラーゲン・ペプチドの研究
食事由来のタンパク質は酵素(ぺプチダーゼ)によりアミノ酸に
分解され、何らかの生理活性を期待しても血中濃度は低レベルであり
役に立たないとする説が一般的ですが、ヒトの血中には
食事由来ペプチド(アミノ酸の小規模集合体)が
存在する(存在できる)ということを確認する作業を
京都大学農学部の佐藤健二教授らは続けているそうです。
その確認作業にはコラーゲン・ペプチドを使用し、
コラーゲンにしか存在しないアミノ酸ヒドロキシプロリン(Hyp)の
末梢血中定量を測定したところ、これまで通説となっていた量より
はるかに大量が検出され、食事後1-2時間後のヒドロキシプロリンの
血漿濃度も食事由来と認められました。
再生医療の遺伝子工学では皮膚の研究が非常に重要で、様々な発見が得られており
皮膚の若返りと線維芽細胞の働きの関連も2014年ごろから論文が
目立つようになり、電子版の専門サイトでは50,000件を
超えているといわれます。
2. コラーゲンとは
食品市場で呼ばれる「コラーゲン」とは「ゼラチン」もしくはゼラチンを低分子化した
「コラーゲンペプチド」を指しています。
コラーゲンは他の成分の結合の無い、線維状の単純タンパク質で動物の骨、皮、髪、腱などの
結合組織に広く分布しています。
脊椎動物では含有するたん白質の3分の1をコラーゲンが占めるといわれています。
特に肌のたんぱく質は70%がコラーゲンで出来ています。(タンパク質はその形状でヘモグロビン、
血清蛋白質、酵素などの球状タンパク質とコラーゲン、ケラチン、エラスチンなどの
線維タンパク質に分けています)
3. コラーゲン摂取の効能
国内最大のコラーゲン生産者であるニッタ・ゼラチンがサポーターとなり
京都大学農学部で進行中の研究では、体内に入ったコラーゲン・ペプチドの半数ぐらいが、
一定条件のもとで筋肉、血管、骨など各組織を生合成することが確認出来たといわれます。
研究は進行中であり結論が出る段階ではありませんが、股関節、ひざ関節の不具合で
激痛に悩まされる中高年には体内でのプロテオグリカン再生の可能性は朗報であり、
研究成果が期待されています。
コラーゲンの摂取により期待されている効果は
体内でのコラーゲン合成を促進
骨を強くし、柔軟性を保つ。
歯の細菌繁殖を防ぎ、虫歯、歯周病を予防する(グリシン)。
骨粗鬆症(こつそしょうしょう)の軽減、関節炎、関節痛を緩和し、円滑な動きをもたらす。
肌の保湿性が高まり、肌に張りを与え、潤いを保つ。
消化器官の潰瘍防止、潰瘍進行抑止(プロリン、アルギニン)。
免疫力を強化して疾病を予防する(グルタミン、アルギニン)。
高血圧の防止、血圧上昇抑制(グリシン)。
スポーツ分野では、関節損傷、骨折などのケガの予防、治療促進が注目されています。
4. コラーゲンが含まれる食品
タンパク質の30%以上がコラーゲンですからタンパク質系の食品に多く含まれますが、
特に、ふかひれ、牛の筋肉、魚の頭、鶏の皮などは重量に対して20-80%もの
コラーゲンを含有する宝庫です。鶏のスープ、にこごりはその集積ともいえます。
5. 人体内のコラーゲン
人間の体重の16%位がたんぱく質で構成され、その内の30-40%がコラーゲンです。
皮膚の70%、骨の20%がコラーゲンで形成され、血管・血液・眼球・腱・筋肉などにも
多く含まれています。
コラーゲンには骨にカルシウムを接着させる役割があります。
骨にコラーゲンがなければ、カルシウムが接着出来ません。
骨ではコラーゲンとカルシウムが次のような配分で組成されます。
コラーゲン 25パーセント
カルシウム 25パーセント
残りは、水や他のミネラルや糖質。
6. コラーゲンの体内吸収と生成
摂取されたコラーゲンが、そのまま体内で活性化するわけではありません。
人の体内では、常にコラーゲンの分解と合成が繰り返し行われています。
体内では消化酵素によりアミノ酸に分解されて、
研究途上ですが新たなるコラーゲンを生成すると考えられています。
吸収能力の高い低分子化されたコラーゲン・ペプチドの摂取が必要なのは
そのためです
アミノ酸 (20種類) の分子量は、種類によって約89~204、コラーゲンの分子量は
だいたい10~30万ほどです。
7. コラーゲンの摂取量と注意事項
骨、肌、関節などに問題のある方はコラーゲンとして1日3-10g摂るのが想定目安量になりますが、
健康維持の目的や若い方は1-2gで十分です(最近は5g)。
ビタミンCとともに摂るのが基本です。
コラーゲンの生成にはプロリルヒドロキシラーゼ(prolyl hydroxylase)という酵素が必要ですが、
この酵素はビタミンCが不足すると機能しません。
またカルシウムとの同時摂取は、骨へのカルシウム吸収に有効です。
腎臓や肝臓に問題がある方、蛋白アレルギーのある方は医師との相談が必要です。
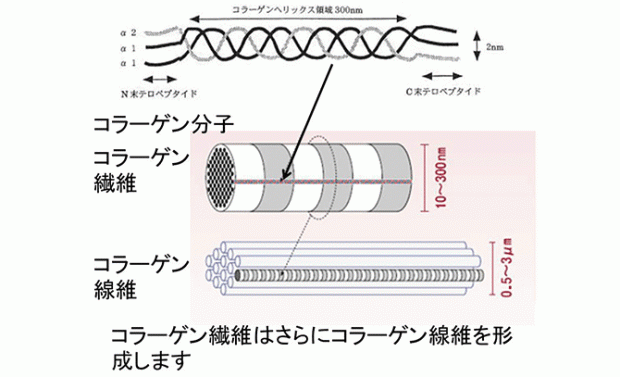
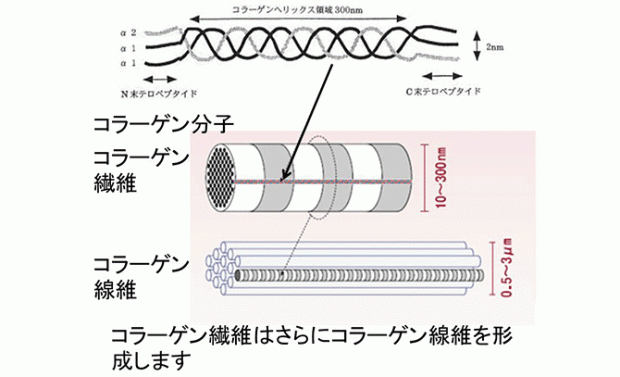
8. コラーゲン分子の構造
コラーゲンは、約10万の分子量をもつ3本のポリペプチド鎖(α鎖)が右巻き、
相互に捻られて構成されています。
コラーゲン分子の構造上の特徴は,ヒドロキシプロリンと
ヒドロキシリジン(Hydroxy proline, Hydroxylysine)というコラーゲン特有の
アミノ酸が2種類含まれていることです。
この二つのアミノ酸はコラーゲン線維構造において重要な役割を担っています。
9. コラーゲンを構成するアミノ酸
ゼラチン、コラーゲンは19種類のアミノ酸で組成されます。
組成では、グリシンが約27-35%、通称イミノ酸(プロリン、オキシプロリン)が約25%と
双方で半分以上を占めるのが特徴的です。
必須アミノ酸ではグルタミン酸約10%、アラニン約9%、アルギニン約8%、
その他ではリジンが比較的多く含まれますが、シスチンやトリプトファンは
基本的には含みません(コラーゲンⅢ型には含まれます)。
アミノ酸分子配列では、3個に1個がグリシンの繰り返しとなっています。
10. コラーゲンの組成タイプ
コラーゲン分子は体内に存在する場所により異なったタイプが18種類くらい確認されています。
サプリメント食品ではⅠ型とⅡ型を原料とするものが、大部分です。
コラーゲンタイプと主として存在する組織の例
- Ⅰ型コラーゲン 骨,皮膚真皮組織。
- Ⅱ型コラーゲン 軟骨組織。
- Ⅲ型コラーゲン 血小板擬集能が優れ、胎児の皮膚,大動脈。
- Ⅳ型コラーゲン 基底膜。組織には下記の例のように混合されて存在します。
I、III、IV、V、及びVI型のコラーゲンは肝臓
Ⅰ型,Ⅲ型コラーゲン 皮膚などの損傷を回復させる肉芽組織。
11. コラーゲンとゼラチン
ゼラチンは、コラーゲンの熱変性物質です。
コラーゲンは難溶性の物質ですが、
これを酸やアルカリで前処理(後述)したのち、加熱すると、
3本のポリペプチド鎖螺旋の分子構造がこわれ、ランダムな3本の分子に分かれます。
このようにして熱変性し、可溶化されたコラーゲンを、「ゼラチン」と呼びます。
ゼラチンのアミノ酸組成は、コラーゲンとほぼ同一です。コラーゲン分子が加熱処理によって
変性すると、3本のα鎖に分かれますが、実際のゼラチン製造では、
それ以外にα鎖の2量体(β成分)と3量体(γ成分)も生成します。
また、原料処理や工程中の熱履歴によって、コラーゲン、ゼラチンの
分子間、分子内結合の一部もランダムに切断されるため、ゼラチンは
種々の分子量を持つ分子の集合体になっています。通常、
市販ゼラチンは、数万~数百万の分子量分布をもっています。
アミノ酸 (20種類) の分子量は、種類によって約89~204、コラーゲンの分子量は
だいたい10~30万ほどです。
注)ノギボタニカルでは親会社がニッタックス(旧新田べニア工業)と40年前に
業務提携.そのご縁から、ゼラチンに関する情報をニッタックスと同根の
㈱新田(ニッタ)ゼラチンのご協力により、「ゼラチン概論」などを転載、
または引用をさせていただきました。
12. ゼラチンの用途と生産量
ゼラチンは、一般的に
食用(ゼリー、ババロア、マシュマロ、グミゼリー、打錠菓子、 ヨーグルト、
アイスクリーム、総菜、スープ、ハム・ソーセージの結着剤、酒のおり下げ剤 など)。
医薬用(ハードカプセル、ソフトカプセル、ミニカプセル、シップ剤、錠剤、トローチ、座薬、止血剤 )。
写真用(写真フィルム、レントゲンフィルム、印画紙、印刷材料 )。
工業用(楽器などの接着剤、研磨紙、マッチ )の4つの用途に分類されます。
(2003年現在の統計)
世界全体の生産量は、約27万トンといわれており、
その内訳は70%が食用で、
医薬用20%、写真用10%とみられます。
写真用が減じていますが、2015年現在も総生産量に大きな変化はありません。
地域別には、ヨーロッパが全体の45%を占め、以下、北米、アジア、南米、
その他の地域の順となっています。
日本国内のゼラチン販売量は、約1万7000トン(2001年)で、用途別には、
食用が50%、写真用30%、医薬用15%、工業用5%の比率になっています。
2015年の予想では写真用が大きく減じているようですが食品用が大幅に増加しており、
総生産量は横ばいのようです。
13. ゼラチンの類似商品
ゼラチンのように、ゼリー(ゲル)を作るための製剤をゲル化剤と呼びます。
-
- ゼラチン(コラーゲン)牛骨、牛皮、豚皮ゼリー、グミ、ババロア、マシュマロ、ソフトヨーグルト、惣菜
- 寒天 (アガロース、アガロペクチン)紅藻類 てんぐさ、おごのり羊かん、ところてん、みつ豆、杏仁豆腐、ハードヨーグルト
- カラギーナン(ガラクトース、アンヒドロ・ガラクトース)紅藻類 つのまた、すぎのりゼリー、プリン、アイスクリーム、シロップ、ムース
- ペクチン(ガラクチュロン酸、ガラクチュロン酸メチルエステ)柑橘類果皮、りんごHM:高糖度ゼリー、ジャム、酸性乳飲料
- LM:ババロア、ジャム、フルーツソース
14. ゼラチンの歴史
コラーゲンのコラーは、ギリシャ語で「にかわ」のことで、ゲンとは「~のもと」という意味だそうです。
日本でコラーゲンが認知されたのは、洋菓子用のゼラチンが輸入され始めた大正時代と言われています。
ゼラチンは、古代エジプトのにかわ製造にその起源を発しているといわれており、
主に接着剤として利用されていたようです。しかし、工業的な規模でゼラチンが生産された国は、
1690年のオランダが最初といわれます。その後、1700年代にはイギリスでも主要産業になり、
さらに1800年代に入ると、フランス、アメリカ、ドイツでも工業化され、現在に至っています。
このように、5000年以前から用いられ、今なおその有用性を保っている素材は多くありません。
1800年頃までは皮が主原料でしたが、1814年にイギリスで脱灰牛骨(オセイン)の
製造技術が確立されたことにより、19世紀初頭には工業的な骨ゼラチンの製造も開始されました。
またこのころには食用ゼラチンも生産されていたといわれています。19世紀後半、写真乳剤に
ゼラチンが応用されるにいたって、ゼラチン工業はさらに発展しました。
一方、日本での工業化の歴史は欧米よりも遅く、1900年代に入ってからです。
この理由の一つとして、日本では寒天が古来、食品素材として利用されていたことがあげられます。
しかし、戦後の食生活の欧米化、嗜好の多様化にともない、食用ゼラチンの国内での消費・生産量は、
ともに年々増加を続けています。
ゼラチンの語源は、ラテン語の “gelatus”(堅い、凍った)に由来し、
この名称は18世紀初めから、一般的に使われるようになったといわれています。(ニッタゼラチン)
15. ゼラチンの原料
工業的なゼラチン生産には、主として牛骨および牛皮、豚皮が原料として用いられます。
このうち、牛骨については、骨の成分の約75%を無機質(リン酸カルシウム)が占めていますので、
これを希塩酸で除去する必要があります。骨を脱灰して残ったコラーゲン主体の物質を
「オセイン」と呼んでいます。これらのコラーゲン原料から、効率良く高品質のゼラチンを
抽出するために、塩酸や硫酸などの無機酸もしくは石灰を用いて、原料の前処理を行ないます。
一般的に、酸処理の場合、数10時間から数日、また石灰処理は2~3ヶ月の処理期間を要します。
原料の前処理条件により、前者を酸処理ゼラチン、後者をアルカリ処理(もしくは石灰処理)
ゼラチンと称します。これらを略して、順にAタイプ、Bタイプとも呼びます。
AタイプとBタイプでは、Bタイプに若干オキシプロリンが多く、逆にチロシンは少ない傾向にあります。